Реферат на тему: «Болезнь Паркинсона»
Подготовила
ученица 10 «Б» класса
Средней
школы № 2 г. Речицы
Кулаженко
Алина
-
Оглавление
Общие сведения
о болезни Паркинсона
Формы
паркинсонизма
Этиология
Генетические
и биохимические аспекты болезни
Паркинсона
Литература
Болезнь
Паркинсона (паркинсонизм)
— хроническое нейродегенеративное
заболевание, сопровождающееся
прогрессирующим разрушением и гибелью
дофаминовых нейронов в ЦНС. Болезнь
Паркинсона была известна и ранее под
названием «дрожательный паралич», но
подробно и полно её впервые описал в
1817 году Джеймс Паркинсон в своей книге
«Эссе о дрожательном параличе». По имени
первоописателя эта болезнь и была
впоследствии названа болезнью Паркинсона.
Это
синдром прогрессирующего поражения
центральной нервной системы
(экстрапирамидной системы), проявляющийся
снижением общей двигательной активности,
замедленностью движений (брадикинизией)
, дрожанием , повышением мышечного
тонуса, тремором , ригидностью и
гипокинезией, акинезией , тремор покоя
и постуральной неустойчивостью в
различных сочетаниях, а также нарушениями
походки и нарушениями позы . Обычно
связан с поражением базальных ганглиев
или их связей с моторными зонами коры
. Паркинсонизм у пожилых встречается
часто. Исследования показали, что в
возрасте 65-74 лет паркинсонизм встречается
у 15% лиц, а в возрасте старше 85 лет — более
чем у 50%.
Формы паркинсонизма
Гетерогенную
группу болезней Паркинсона нозологически
подразделяют на первичный (идиопатический,
генуинный паркинсонизм, дрожательный
паралич, paralysis agitans) и вторичный
(симптоматический) паркинсонизм. К
вторичному паркинсонизму относят
заболевания головного мозга, при которых
обнаруживается паркинсонический
синдром: постэнцефалитический,
атеросклеротический, лекарственный,
токсический.
В
последние годы в связи с развитием
молекулярной генетики в медицинскую
терминологию введены понятия спорадический,
моногенный, семейный паркинсонизм.
Классическая
триада основных симптомов болезней
Паркинсона включает ригидность скелетной
мускулатуры, гипокинезию и тремор
«покоя» конечностей, головы и нижней
челюсти. В современной неврологии в
качестве четвертого характерного
симптома фигурируют постуральные
нарушения.
При
идиопатической форме паркинсонизма
патоморфологические нарушения обусловлены
появлением в цитоплазме нейронов
эозинофильных включений — телец Леви,
диффузно распределенных в черной
субстанции (substantia nigra) среднего мозга,
гипоталамусе, гиппокампе, подкорковых
ганглиях. Регистрируется повреждение
нигральных дофаминергических нейронов,
ведущее к резкому снижению концентрации
дофамина в полосатом теле, следствием
чего является изменение функционального
состояния структуры стриопаллидарного
комплекса. Принято считать, что присутствие
телец Леви одновременно с гибелью
нейронов черной субстанции является
патоморфологической характеристикой,
отличающей идиопатическую форму болезни
Паркинсона от других нейродегенеративных
заболеваний.
К
настоящему времени выдвинуто несколько
гипотез для объяснения причин болезней
Паркинсона (митохондриальная теория;
гипотеза, связанная с накоплением
железа, свободных радикалов, нейротоксинов,
агрессивным действием вирусных инфекций;
теория генетической предрасположенности).
Вероятнее всего несколько механизмов
одновременно или поэтапно могут вести
к формированию риска заболевания.
Основная
часть случаев болезни Паркинсона, за
исключением моногенных наследственных
форм, относится к категории
мультифакториальных нейро-дегенеративных
заболеваний и является результатом
взаимодействия генетических и средовых
факторов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Главная
- Форум 2017
- Медицинские науки
- НЕВРОЛОГИЯ
- БОЛЕЗНЬ ПАРКИНСОНА: ЭТИОЛОГИЯ, КЛИНИКА, СОВРЕМЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ И ТЕРАПИИ
БОЛЕЗНЬ ПАРКИНСОНА: ЭТИОЛОГИЯ, КЛИНИКА, СОВРЕМЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ И ТЕРАПИИ
- Авторы
- Файлы работы
- Сертификаты
Коркмазова Ф.А. 1
1Ставропольский государственный медицинский университет
Комментарии
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
«Болезнь Паркинсона: этиология, клиника, современные методы диагностики и терапии»
Коркмазова Ф. А., Шевченко П.П.
Ставропольский государственный медицинский университет
Кафедра неврологии, нейрохирургии и медицинской генетики
Актуальность:
Болезнь Паркинсона — прогрессирующее мультисистемное заболевание, вовлекающее дофаминергическую, норадренергическую, серотонинергическую и холинергическую системы с широким спектром как двигательных, так и недвигательных (вегетативных, диссомнических, сенсорных, нервно-психических) проявлений. По данным международной ассоциации «Рабочая группа по болезни Паркинсона» в ближайшее время БП заметно коснется лиц трудоспособного возраста [9]. Неуклонно прогрессирующий рост заболеваемости, все еще недостаточная эффективность лечения, тяжелая инвалидизация превращают паркинсонизм в серьезную социальную проблему, требующую интенсивного и внимательного изучения.
Цель: проанализировать по литературным данным современные аспекты этиопатогенеза, клиники, диагностики и терапии болезни Паркинсона.
Результаты: Болезнь Паркинсона (БП) — это хроническое прогрессирующее нейро-дегенеративное заболевание, связанное преимущественно с дегенерацией нигростриарных нейронов и нарушением функции базальных ганглиев. Это заболевание впервые описал лондонский врач Дж. Паркинсон ещё в 1817 г. в «Эссе о дрожательном параличе», и впоследствии оно было названо его именем [7]. БП относится к группе заболеваний, проявляющихся расстройствами движений. Развитие характерного для него синдрома паркинсонизма (акинетико-ригидного синдрома) обусловлено резким снижением количества дофамина в черной субстанции и полосатом теле. На сегодняшний день известно, что болезнь Паркинсона является мультифакториальным заболеванием, на развитие которого оказывают влияние как экзогенные, так и эндогенные факторы [7, 12]. Воздействие этих факторов приводит к формированию нейротоксических агрегатов альфа-синуклеина [13], который является основным структурным компонентом телец Леви (патоморфологический маркер БП) [3]. По данным проведенных исследований, в ряде случаев удается найти связь генной мутации с развитием БП. В частности, мутация а-синуклеина, богатой лейцином киназы-2, гена паркина, РТБИ-индуцированной киназы-1, гена DJ-1 приводит к развитию семейных случаев БП. Однако изолированный аутосомно-рецессивный или доминантный тип наследования встречается довольно редко. Кроме того, риск развития БП при наличии данного заболевания у родственников первой линии выше в три раза, чем в среднем в популяции. Знаменательное современное достижение — доказательство участия процессов воспаления в развитии БП; признаки воспаления обнаружены в зоне черной субстанции, среднего мозга. При БП выявляется повышенная продукция провоспалительных цитокинов, активируется оксидативный стресс, изменяется экспрессия ряда поверхностных молекул, в частности, рецепторов к цитокинам; именно такие признаки отмечаются в образцах тканей, полученных из очагов нейродегенерации при БП [3, 10]. Гипотеза «двойного удара» Hawkes & Braak (2007) основана на первично инфекционном генезе БП. Предполагается проникновение вирусного нейротропного агента в нервную систему двумя путями: 1) назальным — с дальнейшим антероградным распространением в височную долю посредством связей с обонятельными структурами; 2) гастроинтестинальным, который формируется в результате сглатывания назального секрета с пенетрацией в Мейснеровское сплетение и структуры n. vagus с дальнейшей ретроградной трансмиссией в структуры ствола мозга [13]. Внешняя активация апоптоза осуществляется в основном в результате развития эксайтотоксичности (англ. еxcite — возбуждать). Основа этого феномена — нарушение проницаемости ионотрофных рецепторов, регулирующих содержание калия, натрия, хлора и кальция во вне- и внутриклеточном пространстве в результате воздействия возбуждающих нейротрансмиттеров -аминокислот аспартата и глутамата. Результатом активации ионотрофных рецепторов (наиболее часто — рецепторов к N-метил-D-аспартату, NMDA-рецепторов) является повышенное поступление кальция внутрь клетки с последующей стимуляцией протеаз и разрушением клеточных структур. Это сопровождается также активацией перекисного окисления липидов с последующим развитием окислительного (оксидантного) стресса (Tan et al., 1998). В патогенезе БП важную роль играет нарушение дыхательной функции митохондрий за счет блокирования митохондриального комплекса I. Результатом этого становится снижение содержания в клетках АТФ и последующее уменьшение образования глутатиона — универсального антиоксиданта ЦНС. Следующим этапом патогенеза является окислительный стресс, связанный с накоплением свободных радикалов. В условиях окислительного стресса происходит активация NMDA-рецепторов, приводящая к повышенному входу кальция внутрь клетки и дальнейшему развитию апоптоза; некоторые авторы считают также, что окислительный стресс может дополнительно вызывать экспрессию гена р53 с последующей стимуляцией дегенерации нервных клеток. Процесс избирательно поражает нейроны подкорковых образований мозга, в большей степени стриатума и компактной части черного вещества [10, 12]. Современные исследования показали, что преклинический период болезни Паркинсона в среднем составляет от пяти до двадцати лет. Считается, что преклинический период болезни Паркинсона начинается с поражения обонятельных луковиц, передних обонятельных ядер и дорсального ядра блуждающего нерва. К предвестникам болезни Паркинсона относятся беспричинное ухудшение обоняния, яркие и живые сновидения, депрессия и запоры. Вышеперечисленные симптомы могут возникать за много лет до двигательных проявлений БП. Эти недвигательные проявления болезни Паркинсона в будущем могут помочь диагностировать заболевание на его премоторной стадии, что окажет помощь в раннем использовании разработанных лекарственных препаратов, способных модифицировать течение заболевания [3]. Для БП характерны следующие клинические проявления: гипокинезия (обеднение двигательной активности, уменьшение количества и объема движений), сочетающаяся с постепенным развитием пластической мышечной гипертонии нисходящего типа, тремором покоя с частотой 4-6 в 1 секунду, а также постуральными нарушениями в развернутой стадии болезни. Тремор наблюдается у 70-80% пациентов, его особенность — появление в состоянии покоя, исчезновение при произвольном движении, напоминает счет монет, катание пилюль. Более чем в 90% случаев наблюдается асимметричный дебют заболевания (гемипаркинсонизм). Через 1,5-3 года от начала заболевания развивается билатеральный паркинсонизм, появляются характерные нарушения речи, походки, согбенная поза («просителя»), гипомимия. Затем присоединяется четвертый кардинальный симптом паркинсонизма — постуральная неустойчивость [4, 12]. Депрессия, ипохондрия, тревога, апатия встречаются у 50% пациентов. Вегетативные нарушения при БП весьма характерны: никтурия, запоры, импотенция у мужчин, снижение массы тела, себорея, дистальный гипергидроз. На поздних стадиях болезни присоединяются слюнотечение, ортостатическая гипотензия, дисфагия. Для идиопатического паркинсонизма характерно наличие позитивного ответа на терапию препаратами леводопы [4]. Различают несколько клинических форм заболевания: ригидно-брадикинетическую, дрожательно-ригидную и дрожательную [8]. Ригидно-брадикинетическая форма характеризуется повышением тонуса мышц по пластическому типу, прогрессирующим замедлением активных движений вплоть до обездвиженности. Появляются мышечные контрактуры. Характерна «поза манекена» («поза просителя»). Дрожательно-ригидная форма характеризуется тремором конечностей, преимущественно их дистальных отделов, к которому присоединяется скованность произвольных движений. Для дрожательной формы характерно наличие постоянного или почти постоянного средне- и крупноамплитудного тремора конечностей, языка, головы, нижней челюсти. Тонус мышц нормальный или несколько повышен. Темп произвольных движений сохранён.
Диагноз болезни Паркинсона ставится на основе характерной клинической симптоматики заболевания, т. е. является клиническим [5, 11]. В частности, достаточно широко используют клинико-диагностические критерии Банка головного мозга общества БП Великобритании. В настоящее время придается огромное значение доклинической диагностике БП. Именно для доклинической стадии заболевания нейропротективные мероприятия наиболее эффективны, поэтому формирование целевой группы риска развития БП с помощью достоверных биомаркеров БП — первоочередная задача. На сегодняшний день потенциальными инструментальными методами, способными предоставлять биомаркеры БП, являются различные нейровизуализационные подходы, молекулярно-генетический анализ, исследование обоняния, когнитивных, вегетативных функций и т.д. Специфичный и стабильный биомаркер БП — гиперэхогенность черной субстанции, а наиболее доступный, высокоинформативный и неинвазивный метод доклинической диагностики БП — транскраниальная сонография. Данный метод открывает новые возможности для формирования группы риска БП и проведения ранних нейропротективных мероприятий [4,5,10]. С помощью позитронно-эмиссионной томографии (ПЭТ) проводился анализ скорости прогрессирования дегенеративного процесса, и, в частности, было показано, что при БП в среднем накопление снижается в хвостатом ядре на 3 %, а в скорлупе на 9 %, что позволило рассчитать продолжительность доклинической стадии при БП -6 ± 3 года. У части пациентов с клиническим диагнозом БП возможно обнаружение генетических мутаций [3, 4, 5]: на биохимическом уровне имеется дефект активности митохондриального комплекса I, оценка активности которого в тромбоцитах может применяться в качестве биохимического маркёра БП. Также предложено определять уровень тирозин-гидроксилазы, дофамина и рецепторов дофамина в лимфоцитах периферической крови, уровень которых в данных клетках крови, по данным ряда авторов, снижается уже при начальных проявлениях БП. Рядом авторов предлагается оценивать степень поражения чёрной субстанции по уровню железа с помощью транскраниальной ультрасонографии. При этом следует отметить, что обнаруженные нейробиохимические изменения непосредственно в дофаминергических нейронах чёрной субстанции, такие как дефицит глутатиона, накопление железа, дефицит цинка, не являются специфичными только для БП, а также распространены не у всех пациентов с БП. Определённую информацию можно получить, оценивая плотность дофаминовых рецепторов [13]. В частности, показано, что на начальных стадиях плотность постсинаптических Dl-рецепторов не меняется, но отмечается увеличение плотности D2-рецепторов, что отражает механизмы компенсации в условиях дефицита дофамина. На поздних стадиях в большей степени уменьшается плотность D1-рецепторов при относительной сохранности D2-рецепторов, плотность которых остаётся дольше неизменной.
Исходя из патогенеза болезни Паркинсона, в основе современной стратегии лечения данного заболевания лежит соблюдение ряда важнейших принципов: непрерывности лечения; превентивной направленности; рационального выбора и оптимального сочетания противопаркинсонических препаратов; принципа “разумной достаточности” при выборе дозировок препаратов с ориентацией на качество жизни и уровень самообслуживания [1, 5, 8]. В настоящее время известно 7 основных групп противопаркинсонических средств: препараты леводопы; агонисты дофаминовых рецепторов; ингибиторы ферментов метаболизма дофамина — КОМТ и МАО-Б; амантадины; центральные холинолитики; ингибиторы обратного захвата дофамина; антагонисты 2А-аденозиновых рецепторов. Препараты леводопы в настоящее время являются наиболее эффективным средством лечения БП — «золотым стандартом» терапии [6]. Их открытие и активное использование в клинической практике позволило более чем в два раза увеличить продолжительность жизни и значительно улучшить качество жизни пациентов с этим заболеванием [6, 11]. К сожалению, как показала многолетняя практика применения, при лечении леводопой через несколько лет у большинства больных развиваются центральные побочные эффекты в виде двигательных флуктуаций и лекарственных дискинезий. Эти явления значительно видоизменяют клиническую картину и служат одним из наиболее инвалидизирующих факторов на поздних стадиях заболевания. Результаты многолетних исследований продемонстрировали связь развития двигательных флуктуаций со степенью дегенерации нигростриарных нейронов. Известно, что леводопа имеет короткий период полувыведения из плазмы крови — около 90 мин, поэтому на фоне приема отдельных доз в течение суток наблюдаются колебания концентрации препарата в крови. На ранних стадиях заболевания, при сохранении определенного количества нигростриарных нейронов, экзогенный дофамин, образованный из леводопы, накапливается в пресинаптических окончаниях этих нейронов, а затем постепенно высвобождается в синаптическую щель. По мере прогрессирования заболевания уменьшается количество стриарных нейронов и их терми-налей, утрачивается их «буферная» функция, т. е. способность накапливать и стабильно высвобождать дофамин, образованный из леводопы. Таким образом, концентрация дофамина в базальных ганглиях попадает в зависимость от колебаний уровня леводопы в плазме крови [1, 6]. Вскоре после приема очередной дозы концентрация леводопы резко повышается, затем быстро падает, при этом дофаминовые рецепторы подвергаются активации то высокого, то низкого уровня, что в конце концов изменяет их чувствительность, а также функциональное состояние базальных ганглиев. Таким образом, уже через 10 лет после начала практического применения препаратов леводопы была поставлена задача поиска новых лекарственных средств, действующих в обход неуклонно погибающих нигростриарных нейронов, т. е. непосредственно стимулирующих дофаминовые рецепторы. Такими препаратами, воспроизводящими эффект дофамина, стали агонисты дофаминовых рецепторов (АДР). Появление неэрголиновых АДР, таких как прамипексол и ропинирол, позволило существенно пересмотреть тактику ведения пациентов с БП. У пациентов на развернутых стадиях болезни, получающих препараты леводопы, добавление АДР позволило уменьшить их дозу и, следовательно, снизить риск развития и выраженность моторных флуктуаций и дискинезий. В дальнейшем было показано, что данный класс препаратов при использовании в виде монотерапии на начальных стадиях заболевания по эффективности не уступает препаратам леводопы и позволяет отсрочить их назначение [8, 11]. К преимуществам АДР относятся: более длительный (по сравнению с леводопой) период полужизни и более стабильная стимуляция дофаминовых рецепторов; меньший риск развития моторных флуктуаций и дискинезий; отчетливая эффективность в отношении тремора; отсутствие конкуренции с пищевыми аминокислотами, что позволяет принимать препараты вне зависимости от приема пищи; отсутствие необходимости дальнейшего метаболизирования в ЦНС; антидепрессивный эффект некоторых препаратов [1,5]. Одним из наиболее эффективных препаратов этой группы является прамипексол — синтетический неэрголиновый АДР, преимущественно действующий на Dз-подтип D2-дофаминовых рецепторов в стриатуме и лимбической системе. В настоящее время среди всех используемых в мире АДР он является наиболее часто назначаемым при БП препаратом, как в виде монотерапии, так и в комбинации с препаратами леводопы. Клиническая эффективность прамипексола доказана в нескольких рандомизированных двойных слепых плацебо-контролируемых исследованиях, как у нас в стране, так и за рубежом [5, 13]. На ранних стадиях заболевания эффективность современных АДР, в том числе прамипексола, максимально приближается к эффекту леводопы, что позволяет отсрочить ее назначение на несколько лет, тем самым снизив риск развития флуктуаций и дискинезий [12, 13]. Ингибиторы КОМТ рекомендуется использовать совместно с леводопой для стабилизации ответа на леводопу, а также для уменьшения клинических флуктуаций и улучшения двигательных функций на поздних стадиях болезни Паркинсона. Одним из лекарственных средств, используемых при болезни Паркинсона, является амантадин. Изначально амантадин применялся как противовирусный препарат. В 1968 году был впервые обнаружен его противопаркинсонический эффект, и с этого времени амантадин применяется в качестве противопаркинсонического средства. Данные многочисленных исследований, проведенных за последние 15 лет, указывают на то, что амантадин обладает четким противопаркинсоническим эффектом. Ингибиторы МАО-В могут быть использованы для симптоматического лечения болезни Паркинсона в качестве монотерапии на начальных стадиях и в комплексе с леводопой на поздних стадиях болезни Паркинсона [5]. Антихолинергические препараты для лечения болезни Паркинсона в настоящее время используются реже из-за побочных эффектов. В то же время их иногда назначают, если тремор является самым инвалидизирующим симптомом и плохо поддается лечению другими противопаркинсоническими препаратами.
Когда лекарственная терапия становится малоэффективной, должна быть рассмотрена возможность хирургического лечения. Хирургические методы лечения можно разделить на два типа: деструктивные операции и стимуляцию глубинных мозговых структур [1, 10, 11]. К деструктивным операциям применяемым при болезни Паркинсона относятся таломо- и паллидотомия. Глубокая стимуляция субталамических ядер широко используется для лечения осложненного течения болезни Паркинсона. Результатом нейрохирургического лечения являются уменьшение двигательных симптомов болезни Паркинсона (брадикинезия, тремор и др.), возможность существенного снижения дозировок допаминергических препаратов, уменьшение выраженности леводопа-индуцированной дискинезии и сокращение off-периодов.
Выводы: Болезнь Паркинсона (БП) – мировая проблема, так как уже сегодня ею заболевает каждый десятый пациент до 50 лет и каждый двадцатый — до 40 лет. При общей распространенности 0,3% в мире число больных значительно увеличивается с возрастом: — до 1% в группе старше 60 лет и до 4% после 75 лет. Несмотря на предлагаемые новые препараты в лечении БП, наиболее эффективным средством остаются препараты леводопы, являющиеся «золотым стандартом» терапии БП.
Литература:
-
Артемьев, Д.В. Болезнь Паркинсона – возможности лечения / Д.В. Артемьев, М.Р. Нодель, И.Т. Хатиашвили // Неврол. журн. – 2000. – № 2. – С. 53–59.
-
Байрамукова А. М., Ажахметова А.К., Карпов С.М./ Эпидемиология болезни Паркинсона в различных странах мира/ Успехи современного естествознания. 2013г. N9. C. 20-21
-
Бурнусус Н.И., Карпов С.М./ Биохимические маркеры в диагностике ранних форм болезни Паркинсона/ Международный научно-исследовательский журнал/ 2013г. N 10-5 (17)/ c. 13-14
-
Голубев, В.Л. Болезнь Паркинсона и синдром паркинсонизма / В.Л. Голубев, Я.И. Левин, А.М. Вейн. –М.: МЕДпресс-информ, 2000. – 416 с.
-
Диагностика и медикаментозное лечение болезни Паркинсона (зарубежный опыт) / подгот.С. Костюченко // НЕЙРОNEWS. – 2011. – № 7 (34). –С. 54–61
-
Карабань Н.В. Применение леводопасодержащих препаратов на современном этапе лечения болезни Паркинсона /Н.В. Карабань // Міжнародний неврологічний журнал. —2006. — № 6. — С. 16-20.
-
Карпов С.М., Шанхоева Д.Р./ Призначная этиология болезни Паркинсона/Международный научно-исследовательский журнал. 2013г. N.10-5 (17)/ c. 34-35
-
Мироненко Т.В., Храмцов Д.Н., Карпов С.М., Стоянов А.Н., Вастьянов Р.С., Бакуменко И.К., Ямковая Т.Г./ Комплексная коррекция моторных и нейро-вегетативных расстройств у пациентов с посттравматическим паркинсонизмом/ Современные проблемы науки и образования, 2013. N5 с. 284
-
Пугачева В.С., Карпов С.М., Вышлова И.А., Муравьев К.А./ Болезнь Паркинсона: распространенность заболевания с точки зрения медицинской статистики./ Бюллетень науки и практики, 2016. N 5 (6) с. 193-204
-
Суховерская О. Болезнь Паркинсона и паркинсонические синдромы: диагноз и лечение / О. Суховерская // Міжнародний неврологічний журнал. — 2011. — № 6. — С. 16-24.
-
Яхно, Н.Н. Современные принципы терапии болезни Паркинсона / Н.Н. Яхно, М.Р. Нодель // Рус. мед. журн. – 2000. – Т. 8, № 10. – С. 418–425.
-
Antonini, A. Movement disorders: towards new therapies in Parkinson’s disease / A. Antonini // Lancet Neurol. – 2012. – Vol. 11, N 1. – P. 7–8.
-
Graeber M.B. Biomarkers for Parkinson’s Disease /M.B. Graeber // Experimental Neurology. — 2009. — Vol. 216, № 2. — P. 249-253.
Просмотров работы: 1021
Код для цитирования:
Болезнь Паркинсона
МИНЕСТЕРСТВО ЗДРАВООХРАНЕНИЯ
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА НЕВРОЛОГИИ С КУРСОМ ФПО
РЕФЕРАТ
НА ТЕМУ: Болезнь Паркинсона
План
1. Историческая справка
. Определение и распространенность болезни Паркинсона
. Этиология и патогенез
. Современная классификация
. Клиника
. Особенности течения и прогноза
. Диагностика
Список использованной литературы
1. Историческая справка
Год 1817. Один из английских врачей — Джеймс Паркинсон в одной из публикаций описывает странные болезненные изменения, которые он наблюдал у некоторых пациентов. Их тела медленно выходили из-под контроля. Движения становились более медлительными, конечности немели, а мышцы излишне напрягались. Руки и ноги тряслись без видимых причин, а лица каменели, напоминая искусственную маску. Медицина была бессильна. В ходе болезни тела пациентов становились все более и более жесткими. При полном сознании и умственной работоспособности большинство из них умирало, потому что иммобилизация приводила к серьезным пролежням, различным инфекциям в мочевыводящих и дыхательных путях. С тех пор прошло уже более 180 лет. В настоящее время болезнь Паркинсона ( от имени первооткрывателя) не такая великая тайна. Благодаря прогрессу в области медицинских наук нам удалось узнать основные механизмы, вызывающие опасные симптомы. Мы также знаем, как облегчить их, но до сих пор не знаем причин этой болезни и не в состоянии эффективно ее лечить. Между тем, эпидемиологический масштаб не маленький. По некоторым оценкам, с этим заболеванием сталкиваются каждый тысячный человек на пятидесятом году жизни. С возрастом риск увеличивается. Средний возраст начала болезни Паркинсона составляет 58 лет, но известны случаи паркинсонизма среди людей моложе сорока лет жизни.
. Определение и распространенность болезни Паркинсона
Болезнь Паркинсона — прогрессирующее нейродегенеративное заболевание, которое наблюдается не так редко и составляет 1-2% у пожилых людей. Как самостоятельная нозологическая форма, заболевание было описано в 1817 году Джеймсом Паркинсоном (James Parkinson, 1755-1824), указавшего симптомы болезни в книге «Эссе о дрожательном параличе» (An essay on the shaking palsy). В 60-е годы девятнадцатого столетия по предложению французского невролога Пьера Мари Шарко (Pierre Marie Charcot, (1853-1940) заболевание названо «Болезнь Паркинсона». Болезнь Паркинсона — одно из наиболее распространенных неврологических заболеваний. Эпидемиологические исследования указывают на то, что болезнь Паркинсона наблюдается во всех этнических группах, частота несколько выше среди мужчин. Заболеваемость составляет около 20 на 100000 населения, распространенность — 160 на 100000. Заболеваемость и распространенность болезни Паркинсона увеличиваются с возрастом, заболеваемость достигает 55 на 100000 у 70-летних людей. Возможно, возрастание продолжительности жизни в последние десятилетия обусловило увеличение распространенности болезни Паркинсона в развитых странах мира. По данным ВОЗ в мире более 4 миллионов человек страдает болезнью Паркинсона. Паркинсонизм обычно характеризуется классическим сочетанием брадикинезии (замедленности движений), ригидности (скованности) и тремора (дрожания). На более поздних стадиях болезни присоединяется постуральная неустойчивость.
В России, по разным данным, насчитывается от 117000 до 338000 больных БП. После деменции, эпилепсии и церебрососудистых заболеваний БП является наиболее частой проблемой пожилых людей, о чем свидетельствует ее распространенность в России (2012 год): 1.8 : 1000 в общей популяции 1.0: 100 в популяции тех, кому за 70 1.0 : 50 в популяции тех, кому за 80
. Этиология и патогенез
Средний возраст начала БП — 55 лет. В то же время у 10% больных заболевание дебютирует в молодом возрасте, до 40 лет. Заболеваемость паркинсонизмом не зависит от половой и расовой принадлежности, социального положения и места проживания. Предполагают, что с увеличением среднего возраста населения в ближайшие годы распространенность БП в популяции будет увеличиваться. На поздних стадиях заболевания качество жизни больных оказывается существенно сниженным. При грубых нарушениях глотания пациенты быстро теряют в весе. В случаях длительной обездвиженности смерть больных обусловлена присоединяющимися дыхательными расстройствами и пролежнями. Происхождение БП остается до конца не изученным, тем не менее в качестве причины заболевания рассматривается сочетание нескольких факторов: старение; наследственность; некоторые токсины и вещества.
Старение Тот факт, что некоторые проявления БП возникают и при нормальном старении, заставляет предполагать, что одним из причинных факторов паркинсонизма может быть возрастное снижение количества мозговых нейронов. В действительности каждые 10 лет жизни человек теряет около 8% нейронов. Компенсаторные возможности мозга настолько велики, что симптомы паркинсонизма появляются лишь при потере 80% нейронной массы.
Наследственность Уже в течение многих лет обсуждается возможность генетической предрасположенности к БП. Генетическая мутация, как предполагают, может быть вызвана воздействием некоторых токсинов в окружающей среде.
Токсины и другие вещества В 1977 году было описано несколько случаев тяжелого паркинсонизма у молодых наркоманов, принимавших синтетический героин. Этот факт свидетельствует о том, что различные химические вещества могут «запускать» патологический процесс в нейронах головного мозга и вызывать проявления паркинсонизма.
Другие причины БП включают: вирусные инфекции, приводящие к постэнцефалитическому паркинсонизму; атеросклероз сосудов головного мозга; тяжелые и повторные черепно-мозговые травмы.
Длительный прием некоторых препаратов, блокирующих высвобождение или передачу дофамина (например нейролептиков, резерпинсо-держащих средств), может также привести к появлению симптомов паркинсонизма, поэтому всегда следует уточнить, какую терапию получал больной до установления диагноза БП.
На настоящее время этиология окончательно не выяснена. Факторами риска болезни Паркинсона считают старение, воздействие факторов окружающей среды, генетическая предрасположенность, тяжёлые и повторные черепно-мозговые травмы. Нормальное старение патоморфологически сопровождается снижением числа нейронов черной субстанции, а также наличием в них телец Леви. Сопутствуют старению также биохимические изменения в стриатуме — происходит снижение содержания фермента тирозингидроксилазы и дофамина, а также уменьшение количества рецепторов дофамина. Результаты позитронно-эмиссионной томографии красноречиво свидетельствуют о том, что при болезни Паркинсона темпы дегенерации нейронов черной субстанции намного выше, чем при нормальном течении старения.
Семейный анамнез болезни Паркинсона выявляется клиницистами примерно в пятнадцати процентах случаев, однако, гены, отвечающие за развитие этой патологии, ещё не идентифицированы.
Факторы внешней среды (соли тяжелых металлов, гербициды, пестициды), а также хроническая цереброваскулярная недостаточность и употребление лекарственных препаратов, вызывающих экстрапирамидные тяжелые эффекты, могут также стать причинами паркинсоноподобных проявлений.
К факторам риска относят проживание рядом с карьерами и промышленными предприятиями.
Однако, интересный факт — у курильщиков риск развития данной патологии в три раза ниже, чем у некурящих. Клиницисты связывают данное явление с дофамин-стимулирующим действием никотина, а также с наличием в табачном дыме соединений, действующих подобно ингибиторам МАО. Употребление кофеина также защищает от развития болезни Паркинсона.
Были отмечены случаи тяжелого паркинсонизма у наркоманов молодого возраста, употреблявших синтетический героин.
Существует на настоящий момент ряд гипотез и теорий возникновения болезни Паркинсона. Остановимся подробнее на одной из них — окислительной гипотезе. Она указывает на ведущую роль свободных радикалов, образующихся при окислительном метаболизме дофамина. Содержание доноров электронов в черном веществе увеличивается, это ведёт к образованию свободных радикалов; также под воздействием МАО при окислении дофамина образуется перекись водорода. Если она не связывается с глутатионом, то реактивные гидроксильные радикалы накапливаются, вызывая в итоге перекисное окисление липидов клеточных мембран, ведущее к гибели клетки.
Патологическая анатомия
Происходит поражение структур экстрапирамидной системы — базальных ядер и черного вещества, голубого пятна и др. Наиболее выраженные изменения отмечаются в передних отделах черной субстанции. При гибели восьмидесяти процентов нейронов данного образования возникают симптомы, характерные для болезни Паркинсона.
Макроскопически изменения характеризованы депигментацией областей черного вещества и голубого пятна, содержащих меланин. При микроскопии пораженных областей выявляется снижение количества нервных клеток, в которых определяются тельца Леви. Они образуются вследствие скопления α-синуклеина в цитоплазме. Тельца Леви не считаются клиницистами маркером болезни Паркинсона, также и при прочих нейродегенеративных заболеваниях.
Выявляются в черной субстанции так называемые «бледные пятна», представляющие гранулярные внутриклеточные включения, замещающие распадающийся меланин.
Также при микроскопии обнаруживается активация микроглии и гибель астроцитов.
В асимптоматической стадии тельца Леви проявляются также в нервных клетках продолговатого мозга, обонятельной луковицы и варолиевого моста. С прогрессированием патологии, наличие данных телец выявляется в нейронах черной субстанции, базальных ганглиев, среднего мозга и, на конечных этапах, в клетках, образующих кору головного мозга.
По данным проведенных исследований, в ряде случаев удается найти связь генной мутации с развитием БП. В частности, мутация ?-синуклеина, богатой лейцином киназы-2, гена паркина, PTEN-индуцированной киназы-1, гена DJ-1 приводит к развитию семейных случаев БП. Однако изолированный аутосомно-рецессивный или доминантный тип наследования встречается довольно редко. Кроме того, риск развития БП при наличии данного заболевания у родственников первой линии выше в три раза, чем в среднем в популяции. Причину избирательного наследования связывают с наличием так называемых генов риска, которые увеличивают вероятность развития БП у того или иного индивидуума .
Знаменательное современное достижение — доказательство участия процессов воспаления в развитии БП; признаки воспаления обнаружены в зоне черной субстанции, среднего мозга. При БП выявляется повышенная продукция провоспалительных цитокинов, активируется оксидативный стресс, изменяется экспрессия ряда поверхностных молекул, в частности рецепторов к цитокинам; именно такие признаки отмечаются в образцах тканей, полученных из очагов нейродегенерации при БП . Предполагается, что аномальная складчатая ?-форма -синуклеина образуется в эпителии обонятельных луковиц под влиянием факторов внешней среды (например, вируса герпеса 1-го типа и др.), затем трансневрально распространяется на структуры мозга, имеющие связи с обонятельными луковицами. Стадийность распространения патологического процесса с постепенным вовлечением образований ствола, лимбической системы и коры подтверждается гипотезой H. Braak (2003). После обонятельных луковиц и стволовых образований (locus coeruleus, nuclei raphe) черная субстанция (SNc) вовлекается в нейродегенеративный процесс только на 3-й стадии распространения -синуклеина, следующими на очереди оказываются корковые области .
Гипотеза «двойного удара» Hawkes & Braak (2007) основана на первично инфекционном генезе БП. Предполагается проникновение вирусного нейротропного агента в нервную систему двумя путями: 1) назальным — с дальнейшим антероградным распространением в височную долю посредством связей с обонятельными структурами; 2) гастроинтестинальным, который формируется в результате сглатывания назального секрета с пенетрацией в Мейснеровское сплетение и структуры n. vagus с дальнейшей ретроградной трансмиссией в структуры ствола мозга . Внешняя активация апоптоза осуществляется в основном в результате развития эксайтотоксичности (англ. еxcite — возбуждать). Основа этого феномена — нарушение проницаемости ионотропных рецепторов, регулирующих содержание калия, натрия, хлора и кальция во вне- и внутриклеточном пространстве в результате воздействия возбуждающих нейротрансмиттеров — аминокислот аспартата и глутамата. Результатом активации ионотропных рецепторов (наиболее часто — рецепторов к N-метил-D-аспартату, NMDA-рецепторов) является повышенное поступление кальция внутрь клетки с последующей стимуляцией протеаз и разрушением клеточных структур. Это сопровождается также активацией перекисного окисления липидов с последующим развитием окислительного (оксидантного) стресса (Tan et al., 1998). Среди поражений нервной системы особую роль апоптоз играет в развитии дегенеративных заболеваний, в том числе БП. Общий радикал всех дегенеративных заболеваний головного и спинного мозга — снижение устойчивости нервных клеток к стимуляторам апоптоза — эксайтоаминокислотам, вирусным белкам или ионам кальция . В этом аспекте паркинсонизм является модельной ситуацией. В его патогенезе важную роль играет нарушение дыхательной функции митохондрий за счет блокирования митохондриального комплекса I. Результатом этого становится снижение содержания в клетках АТФ и последующее уменьшение образования глутатиона — универсального антиоксиданта ЦНС. Следующим этапом патогенеза является окислительный стресс, связанный с накоплением свободных радикалов. В условиях окислительного стресса происходит активация NMDA-рецепторов, приводящая к повышенному входу кальция внутрь клетки и дальнейшему развитию апоптоза; некоторые авторы считают также, что окислительный стресс может дополнительно вызывать экспрессию гена р53 с последующей стимуляцией дегенерации нервных клеток. Процесс избирательно поражает нейроны подкорковых образований мозга, в большей степени стриатума и компактной части черного вещества. Терапия препаратами леводопы может активировать апоптоз, поскольку усиливает окислительный стресс .
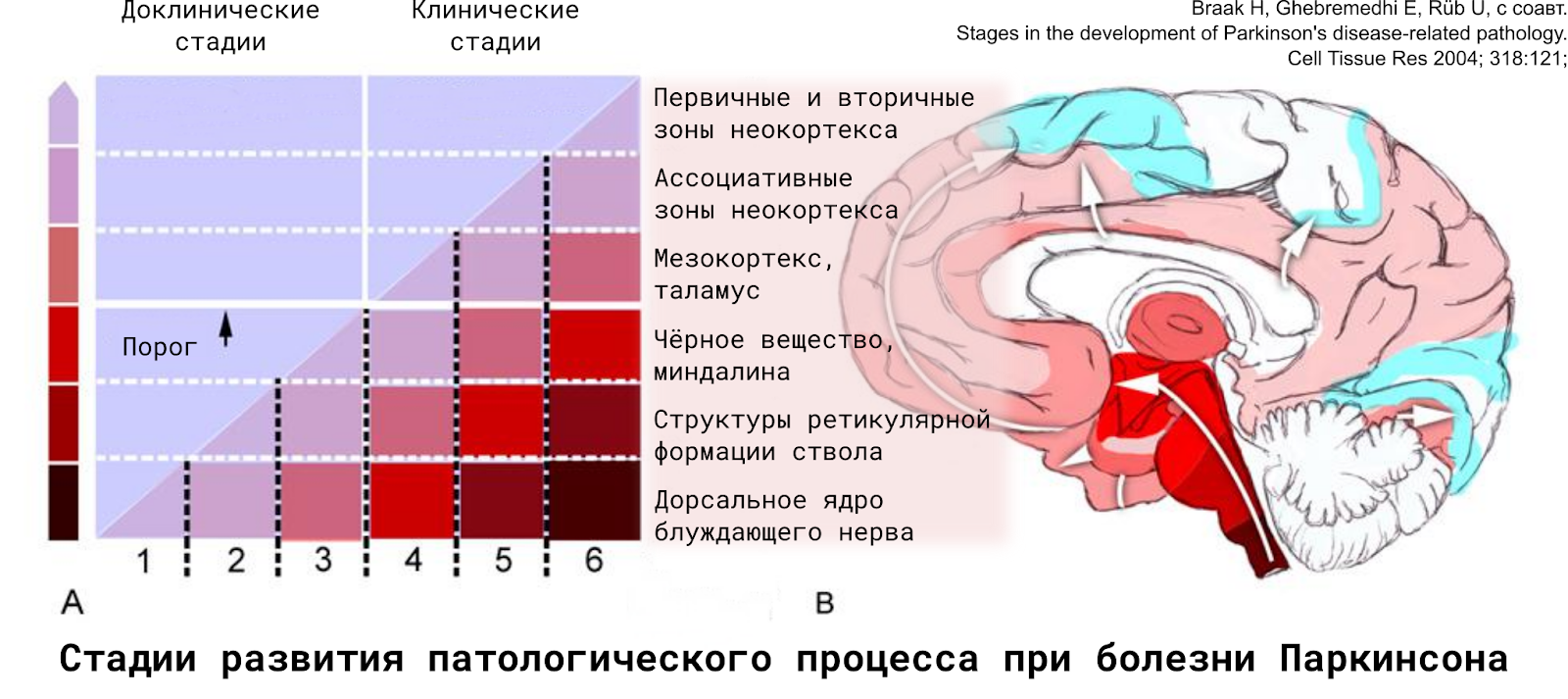
При БП отмечается широкий спектр моторных и немоторных проявлений. Период до поражения SNc может быть достаточно длительным (до 10 лет), характеризуется следующими немоторными проявлениями БП: нарушением обоняния, расстройством сна, депрессией, запорами, изменением цветовосприятия, гиперэхогенностью черной субстанции при транскраниальной сонографии, снижением захвата дофамина стриатумом при позитронно-эмиссионной томографии; реже возникают боли, синдром беспокойных ног, апатия, утомляемость, тревога . Поражение обонятельной луковицы, переднего ольфакторного ядра, дорсального моторного ядра блуждающего нерва, периферических ганглиев вегетативной нервной системы, пре- и постганглионарных симпатических и парасимпатических структур кишечного, сердечного и тазового сплетений в первой стадии клинически проявляется гипосмией, запорами, нарушением симпатической иннервации миокарда (вазодилатацией, снижением силы сердечных сокращений, расстройством вариабельности сердечного ритма, ортостатической гипотензией). Во второй стадии в патологический процесс вовлекаются ядра продолговатого мозга и моста (в том числе ядро шва, голубоватое пятно, ретикулярная формация). Клинически вторая стадия может проявляться расстройством сна и бодрствования (быстрыми движениями глаз во время сна, дневной сонливостью, нарушением засыпания), депрессией, апатией, когнитивным дефицитом, вегетативной дисфункцией. Поражение черной субстанции, миндалин, базальных отделов переднего мозга (третья стадия) проявляется присоединением моторных симптомов (тонких нарушений моторики). Четвертая стадия характеризуется вовлечением височного мезокортекса и гиппокампа, гибелью 60% дофаминергических нейронов черной субстанции, уменьшением выработки дофамина на 80%. Клиника дополняется тремором, ригидностью, гипокинезией, разнообразными проявлениями вегетативной дисфункции. Ассоциативные зоны префронтальной, височной и теменной коры заинтересованы в пятой стадии, моторные и сенсорные зоны коры — в шестой. Нарастают когнитивные, поведенческие и психотические расстройства . Когнитивные нарушения появляются еще на домоторной стадии заболевания, определяют качество жизни пациентов, нередко являются причиной инвалидизации.
Средняя распространенность деменции при БП составляет 30%. Риск развития деменции при БП в 4-6 раз выше, чем в среднем в популяции у лиц того же возраста . На протяжении всей жизни человек, который заболеет БП во второй период жизни, уже с момента личностного формирования будет отличаться обязательностью, надежностью, не слишком высокой потребностью к поиску нового, наряду с отсутствием демонстративности и элементами социальной фобии. Считается, что эти особенности личности являются маркерами изначально дефектной дофаминовой иннервации, что дофаминовый дефицит и нарушение дофаминовой иннервации нарушают процессы нейрогенеза в обонятельных луковицах и создают условия для зарождения конформационно измененного белка в их эпителии, откуда и начинается распространение нейродегенеративного процесса в другие наиболее уязвимые структуры мозга, имеющие тесные анатомические связи с обонятельными луковицами
4. Современная классификация
Классификация болезни Паркинсона проводится по форме, стадии и темпу прогрессирования заболевания.
Формы заболевания. В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: смешанную (акинетико-ригидно-дрожательную), акинетико-ригидную и дрожательную. Смешанная форма выявляется в 60-70 % случаев болезни Паркинсона, акинетико-ригидная — в 15-20 % случаев болезни Паркинсона, дрожательная — в 5-10 % случаев болезни Паркинсона. По мере прогрессирования заболевания его форма может меняться.
Стадии заболевания. Общепризнанной является классификация стадий болезни Паркинсона, предложенная Hoehn и Yarh (1967):
Стадия 1. Односторонние проявления заболевания (только конечности).
Стадия 1.5. Односторонний процесс (конечности и одноименная сторона туловища).
Стадия 2. Двустороннее заболевание без постуральной неустойчивости.
Стадия 2.5. Начальные проявления двустороннего процесса с возвращением к норме при исследовании.
Стадия 3. Умеренно выраженная постуральная неустойчивость, возможно самостоятельное передвижение.
Стадия 4. Значительная утрата двигательной активности, пациент не в состоянии передвигаться без посторонней помощи.
Стадия 5. В отсутствие посторонней помощи пациент прикован к постели или инвалидному креслу.
Темп прогрессирования. Выделяют три варианта темпа прогрессирования болезни Паркинсона (при условии адекватного лечения):
быстрый темп прогрессирования, при котором смена стадий заболевания (первая — вторая или вторая — третья) происходит в течение 2 или менее лет;
умеренный темп прогрессирования, при котором смена стадий происходит более чем за 2 года, но не более чем за 5 лет;
медленный темп прогрессирования со сменой стадий более чем через 5 лет.
паркинсон болезнь нейродегенеративный дрожательный
5. Клиника
Основные симптомы
Основные признаки болезни Паркинсона это двигательные нарушения: гипокинезия, ригидность, тремор, постуральные расстройства.
Гипокинезия
Гипокинезия характеризуется замедленностью движений (брадикинезия), затруднением инициации движений, неспособностью генерировать адекватное по силе и темпу мышечное усилие (гипометрия), например, при изменении положения тела, быстрым уменьшением амплитуды и скорости при повторяющемся движении (олигокинезия), например, при сжимании и разжимании кисти. Гипокинезия проявляется следующими симптомами:
·Гипомимия (бедность реакции лицевой мимики).
·Редкое мигание.
·Гипофония (тихая речь).
·Микрография (мелкий почерк).
·Брахибазия (укорочением длины шага).
·Затруднения при вставании со стула, при поворотах в стороны, ходьбе.
Ригидность
Мышечная ригидность представляет собой повышение мышечного тонуса, проявляющееся повышенным сопротивлением пассивным движениям. Повышенное сопротивление может быть монотонным (феномен «восковой куклы») или прерывистым (феномен «зубчатого колеса»).
Тремор (дрожание)
Возможны несколько вариантов тремора.
Классический паркинсонический тремор покоя частотой 3-6 Гц, в руке внешне напоминает «скатывание пилюль» или «счет монет». Тремор возникает в покоящейся конечности, уменьшается при движении в ней, но усиливается в покое, при активных движениях в других конечностях, при ходьбе и отвлечении внимания. Паркинсонический тремор нередко бывает асимметричным или односторонним (со временем приобретая двусторонний характер). Наиболее часто тремор покоя бывает в руках, иногда вовлекаются ноги (обычно в дистальных отделах руки или ноги), подбородок, губы, весьма редко голова. Тремор наблюдается в 80 — 85% случаев заболевания.
Постуральный тремор возникает при поддержании позы (тремор вытянутых вперед или в стороны рук). Постуральный тремор нередко сочетается с тремором покоя причем, как правило, бывает той же частоты и локализации. Дифференциально-диагностическим признаком отличия постурального тремора при паркинсонизме от эссенциального тремора служит то, что он появляется не сразу после вытягивания рук вперед, а спустя несколько секунд.
У ряда больных при паркинсонизме выявляется высокочастотный (6-12Гц) постурально-кинетический тремор, напоминающий эссенциальный тремор, который иногда появляется за несколько месяцев или лет до развития основных проявлений паркинсонизма.
Постуральные расстройства (постуральная неустойчивость)
Постуральные рефлексы обеспечивают поддержание равновесия и вертикальное положение тела. Их ослабление или утрата проявляется в нарушении способности удерживать равновесие при изменении положения тела или при ходьбе, что в комбинации с гипокинезией и ригидностью приводит к нарушению ходьбы и падениям. Когда больной инициирует начало ходьбы или пытается изменить направление своего движения, то создается впечатление, что он топчется на месте, все более наклоняясь вперед. При этом он пытается догнать центр тяжести тела мелкими семенящими шажками (пропульсия), что нередко заканчивается падением.
Характерные нарушения в не двигательной сфере
·Психические нарушения и нервно-психические расстройства.
·Депрессия (до 50% случаев БП).
·Тревога, включая панические атаки.
·Когнитивные нарушения, деменция (20-80%).
·Психозы (менее 10% у не леченых больных, и в 15-40% случаев у больных, получающих лечение).
·Апатия, безразличие, вялость.
·Делирий.
·Навязчивые состояния.
·Патологическое влечение к азартным играм.
·Патологическое влечение к покупкам в магазине (шопингу).
·Гиперсексуальность.
·Пристрастие к еде.
·Нарушения сна.
·Инсомния.
·Дневная сонливость (в 50% случаев).
·Синдром беспокойных ног.
·Сонные апноэ.
·Внезапные засыпания.
·Яркие сновидения.
·Вегетативные нарушения.
·Дисфагия (нарушение глотания) и ощущение удушья.
·Гиперсаливация (повышенное слюнообразование).
·Нарушения мочеиспускания, такие как ночные мочеиспускания, учащение мочеиспускания.
·Повышенная потливость.
·Ортостатическая гипотензия.
·Сухость во рту.
·Запоры.
·Нарушения половых функций.
·Себорея
·Ощущение усталости.
·Двоение зрения, нечеткость зрения.
·Потеря веса.
·Чувствительные нарушения.
·Нарушения обоняния (снижение (гипосмия) или отсутствие (аносмия) обоняния) в 70-100% случаев.
·Боли в связи с двигательными нарушениями или мышечного характера. Широко распространенный симптом.
·Парестезии (покалывание, ползание мурашек, онемение, жжение и т. д.).
Клиника дебюта заболевания
В основном наблюдается два варианта начала болезни Паркинсона.
Начало болезни Паркинсона проявляется исподволь, неврологические проявления асимметричны, обычно начинаются с дрожания (тремора) или неловкости в одной руке (около 20% случаев) или ноге, реже затруднением походки или общей скованностью. Тремор обычно проявляется в одной конечности. Может наблюдаться колебание степени его выраженности. Амплитуда дрожания увеличивается после стрессовых нагрузок и уменьшается после сна. Пациент может отмечать ограничение подвижности при движении в пораженной руке, задевание ногой об пол. Через какое то время осанка становится всё более сутулой и наблюдается укорочение длины шага.
Вначале больные часто жалуются на боли в конечностях или спине, мышечные судороги. Некоторые пациенты ощущают болезненность или чувство сжатия, давления в области плеча или икроножной области. Начальные симптомы болезни Паркинсона могут быть неспецифичны и проявляться усталостью, депрессией, нарушениями сна. Характерны также вегетативные нарушения: запоры, ортостатическая гипотензия, импотенция, нарушения мочеиспускания, нарушения потоотделения, себорейный дерматит.
Клиническая картина прогрессирования заболевания
Через несколько месяцев (лет) от начала заболевания тремор может проявиться в конечностях противоположной стороны тела, но асимметрия обычно сохраняется. Тремор также может проявиться в языке, губах, шее, голосовых связках.
Нарастает замедленность движений (брадикинезия), затрудняется начало движений, уменьшается их амплитуда, особенно при повторении, исчезают содружественные движения. Развивается «поза просителя» — осанка становится сутулой, руки сгибаются в локтях, ноги в коленных суставах. Замедляется ходьба, укорачивается шаг, снижается высота шага, что приводит к шаркающей походке. При начале ходьбы больные делают несколько мелких шагов, топчутся на месте. Лицо становится маскообразным (гипомимия), почерк мелким (микрография).
Речь становится монотонной, дисфоничной вплоть до дизартрии (в грубой форме встречается редко).
Гипокинезия в глотательных мышцах приводит к снижению глотания, что вызывает избыточное накопление слюны в полости рта и в конечном итоге к слюнотечению.
Развиваются психические нарушения: депрессия более чем в 50% случаев, деменция (в среднем у 15 — 30% больных и в 70 — 80% случаев на поздней стадии заболевания), замедленность психической деятельности (брадифрения) и снижение внимания, острые психотические нарушения (в 25% случаев) в виде зрительных галлюцинаций.
Психозы часто провоцируются сменой противопаркинсонического препарата или увеличением дозы препарата (лекарственные психозы). Вначале проявляются в виде появления изображений людей или животных на фоне относительно ясного сознания, не носят устрашающего характера, больной сохраняет критику к своему состоянию. По мере прогрессирования галлюцинации приобретают устрашающий характер, критика утрачивается, присоединяются бредовые нарушения. Развивается делирий, дезориентация, психомоторное возбуждение.
Клиническая картина на позднем этапе заболевания
Утрачиваются постуральные рефлексы, что проявляется неустойчивостью походки, падениями. Наблюдается феномен пропульсии — ускорение движения вплоть до перехода на короткий бегущий шаг, чтобы сохранить равновесие в условиях наклона туловища вперед и соответствующего перемещения центра тяжести тела кпереди.
Развивается парадоксальная акинезия (застывание) — внезапная блокада осуществляемого движения, когда больной на некоторое время становится не способен сдвинуться с места.
Иногда наблюдается парадоксальная кинезия — больной, с трудом передвигающийся самостоятельно, легко всходит по лестнице или идет по нарисованной линии.
Возникают периоды декомпенсации длительностью до нескольких недель. Основные причины декомпенсации: отмена или резкое снижение дозы противопаркинсонических средств, прием блокаторов дофаминовых рецепторов и седативных средств, общесоматические заболевания, оперативные вмешательства. Клиническая картина декомпенсации складывается из нарастания основных клинических проявлений болезни с развитием обездвиженности, нарушением речи и глотания; появлением спутанности сознания, зрительных галлюцинаций, параноидного бреда, а также признаков вегетативной нестабильности (ортостатическая гипотензия, нарушения сердечного ритма, терморегуляции, потоотделения, мочеиспускания).
6. Особенности течения и прогноза
Осложнения
Соматические осложнения
·Бронхопневмония.
·Уроинфекции.
Неврологические осложнения
Неврологические осложнения собственно болезни Паркинсона обычно рассматриваются вместе с осложнениями терапии, в первую очередь препаратами леводопы.
·Депрессия.
·Ранние побочные эффекты терапии дофаминергическими препаратами.
·Тошнота.
·Рвота.
·Анорексия (отсутствие аппетита при наличии физиологической потребности в питании).
·Ортостатическая гипотензия. Обычно проявляется более или менее острым снижением артериального давления вскоре после приёма дофасодержащего препарата .
·Липотимические (предобморочные) состояния и обмороки развиваются при смене горизонтального или сидячего положения тела на вертикальное (вставание или просто длительное стояние).
·Гипергидроз (повышенное потоотделение).
Поздние побочные эффекты дофасодержащих препаратов (наступают спустя 3 — 9 лет от начала терапии).
Моторные флуктуации (колебания двигательной активности). Наблюдаются у 70% пециентов после 9 лет лечения леводопой. Самая распространенная форма моторных флуктуаций — феномен «изнашивания»: возобновление или значительное усиление симптомов БП меньше чем через 4 часа после приема последней дозы леводопы, а также синдром (феномен) «включения-выключения», который проявляется внезапным чередованием периодов двигательной активности и обездвиженности вне зависимости от времени приема леводопы.
Дискинезии (гиперкинезы, избыточная двигательная активность). Проявляются в виде хореоатетоза (непрерывный поток непроизвольных, неритмичных, хаотичных быстрых движений) и дистонии (непроизвольные медленные или повторяющиеся быстрые движения, вызывающие вращение, сгибание или разгибание отдельных частей тела с формированием патологических поз). Дискинезии «включения» проявляются появлением гиперкинезов на высоте антипаркинсонического действия леводопы. Двухфазные дискинезии возникают в начале и в конце улучшения, связанного с приемом дозы леводопы. Дистония «выключения» появляется в период снижения действия дозы леводопы.
·Зрительные галлюцинации.
·Инсомния (неудовлетворенность сном, бессонница).
·Спутанность сознания.
. Диагностика
Когда необходимо заподозрить болезнь Паркинсона
Нужно думать о болезни Паркинсона, когда у пациента развивается замедленность движений (брадикинезия), и/или затруднение инициации произвольных движений, и/или неспособность генерировать адекватное по силе и темпу мышечное усилие (гипометрия) — т.е. признаки гипокинезии, в сочетании с хотя бы одним из симптомов, как то повышение мышечного тонуса (ригидность), дрожание в руках и/или ногах частотой 4 — 6 Гц, неустойчивость при ходьбе.
Распознавание начальных стадий болезни Паркинсона часто осуществляется с большим трудом в связи с тем, что дебют этого заболевания развивается субклинически, и проходит немало времени до того, как больной обратится к врачу.
Задачи диагностики
Идентификация синдрома паркинсонизма, используя клинические критерии диагностики в виде наличия у пациента гипокинезии и еще как минимум одного из трех признаков — мышечной ригидности, постурального тремора 4 — 6 Гц и/или постуральной неустойчивости.
Дифференциальная диагностика болезни Паркинсона и вторичного паркинсонизма (с его разнообразными причинами) и синдромами паркинсонизм плюс (паркинсонизм при мультисистемных нейродегенеративных заболеваниях).
Выявление дополнительных клинических признаков в пользу болезни Паркинсона и признаков не характерных для нее. Дополнительные признаки за и против диагноза заболевания могут существенно подкрепить уверенность в диагнозе, с учетом того, что диагноз болезни Паркинсона опирается исключительно на клинические данные, и на сегодня практически отсутствуют лабораторные и инструментальные методы подтверждения диагноза.
Необходимо установить форму болезни Паркинсона (смешанная, акинетико-ригидная, дрожательная) и стадию заболевания, используя, например, наиболее распространенное деление на стадии с целью подбора терапии.
Критерии диагноза болезни Паркинсона
1.Наличие гипокинезии и как минимум одного из следующих симптомов:
2.Мышечная ригидность.
.Тремор покоя 4 — 6 Гц.
.Постуральные нарушения (неустойчивость), не связанные с первичными зрительными, вестибулярными, мозжечковыми или проприоцептивными расстройствами.
Клинические данные в пользу диагноза (Критерии, подтверждающие диагноз)
1.Асимметрия симптоматики (одностороннее начало, гемипаркинсонизм), в частности, асимметричный дебют заболевания.
2.Сохранение асимметрии симптоматики с преобладанием на первоначально вовлеченной стороне.
.Относительно медленное прогрессирование с сохранением способности к самостоятельному передвижению в течение не менее 5 лет.
.Тремор покоя частотой 3-6 Гц по типу «скатывания пилюль».
.Хороший стойкий положительный эффект от применения леводопы (уменьшение симптомов на 70 — 100%).
.Сохранение реакции на леводопу в течение 5 лет и более.
.Выраженный хореиформные дискинезии, индуцированные леводопой.
.Наличие нарушений обоняния. Является ранним признаком и может возникать до появления двигательных нарушений. Наблюдается в 70-100% случаев болезни Паркинсона. Нарушения обоняния проявляются гипосмией (снижением способности различать запахи) или аносмией (отсутствием способности различать запахи).
.Течение заболевания в течение 10 лет и более.
.Отсутствие признаков не характерных для болезни Паркинсона.
Признаки не характерные для болезни Паркинсона (Критерии исключения болезни Паркинсона)
1.Отсутствие в анамнезе возможных этиологических факторов вторичного паркинсонизма. Повторные инсульты в анамнезе со ступенеобразным прогрессированием симптомов паркинсонизма. Повторные черепномозговые травмы в анамнезе. Энцефалит в анамнезе. Окулогирные кризы. Лечение нейролептиками на момент появления симптомов.
2.Острое начало или спонтанный регресс симптомов.
.Быстрое прогрессирование с развитием обездвиженности в течение 5 лет.
.Наличие длительной ремиссии.
.Отсутствие реакции на высокие дозы леводопы.
.Семейный характер заболевания (более 1 родственника с признаками паркинсонизма).
.На раннем этапе заболевания не характерно:
.Раннее развитие выраженной дизартрии или дисфагии.
.Развитие в течение первых 3 лет грубых постуральных расстройств, частых падений, застываний.
.Раннее развитие деменции (с нарушениями памяти, речи и праксиса) и зрительных галлюцинаций.
.Развитие ранней, грубой, прогрессирующей вегетативной недостаточности.
.Слабая или нестойкая реакция на терапию леводопой.
.Строго односторонняя симптоматика более 3 лет.
.Присутствие мозжечковых и пирамидных знаков(симптома Бабинского и др), мышечных атрофий, паралича взора вниз, псевдобульбарных нарушений .
.Выявление атрофии мозжечка или гидроцефалии при КТ или МРТ.
Лабораторные и инструментальные методы диагностики
При болезни Паркинсона отсутствуют характерные лабораторные тесты, также как отсутствуют патогномоничные изменения при МРТ и КТ головного мозга. Тем не менее нейровизуализационные методы могут быть использованы в случае подозрения на вторичный паркинсонизм, у пациентов с атипическими проявлениями паркинсонизма, у пациентов, не самым оптимальным образом отвечающих на терапию.
Позитронная эмиссионная томография и гамма томография могут быть использованы для подтверждения диагноза болезни Паркинсона начиная с ранней стадии заболевания. Тем не менее, нет необходимости в их проведении в типичных клинических случаях. К тому же эти исследования крайне малодоступны в клинической практике.
Дифференциальная диагностика болезни Паркинсона
·Вторичный паркинсонизм (синдром паркинсонизма)
·Болезнь Альцгеймера
·Кортикобазальная дегенерация
·Прогрессирующий надьядерный паралич
·Мультисистемная атрофия
·Эссенциальный тремор
·Нормотензивная гидроцефалия
·Лобно-височная деменция с паркинсонизмом
·БАС — паркинсонизм — лобная деменция
·Болезнь диффузных телец Леви
·Болезнь Геллервордена — Шпатца
·Ювенильная форма хореи Гентингтона
Список использованной литературы
1.Карабань, И.Н. Применение блокатора глутаматных рецепторов «Амантадина» в неврологии / И.Н. Карабань // Междунар. мед. журн. — 2012. — Т. 2, № 48. — С. 2-8.
2.Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика) / Г.Н. Крыжановский [и др.]. — М.: Медицина, 2002. — 336 с.
.Кучеряну, В.Г. Влияние глутамата и антагонистов N-метил-D-аспартат (NMDA)-рецепторов на экспериментальный паркинсонический синдром у крыс / В.Г. Кучеряну, Г.Н. Крыжановский // Бюл. эксперим. биологии и медицины. — 2000. — Т. 130, № 7. — С. 20-23.
.Левин, О.С. Леводопа и леводопофобия / О.С. Ле-вин // НЕЙРОNEWS. — 2011. — № 2/1. — С. 44-50.
.Левин, О.С. Болезнь Паркинсона / О.С. Левин, Н.В. Федорова. — М.: МЕДпрессинформ, 2012. — 315 с.
.Нодель, М.Р. Болезнь Паркинсона. Современные возможности терапии: методические рекомендации / М.Р. Нодель; подгот. под ред. Н.Н. Яхно. — М., 2008. — 40 с.
.Обзор материалов III Украинской научно-практической конференции с международным участием «Экстрапирамидные заболевания и возраст» / подгот. М.А. Чивликлий // Междунар. неврол. журн. — 2010. — № 2 (32). — С. 135-138.
.Ортель, В.Х. Лекарственная терапия болезни Паркинсона / В.Х. Ортель, А.М. Коршунов // Неврол. журн. — 1997. — № 6. — С. 4-8.
.Пономарев, В.В. Диагностика болезни Паркинсона на ранних стадиях заболевания / В.В. Пономарев, Е.В. Мазуренко // Мед. новости. — 2012. — № 1. — С. 13-16.
.Слободин, Т.Н. Современные представления о патогенезе болезни Паркинсона / Т.Н. Слободин // НЕЙРОNEWS. — 2011. — № 7 (34). — С. 22-27.
.Шток, В.Н. Экстрапирамидные расстройства: рук-во по диагностике и лечению / В.Н. Шток, И.А. Иванова-Смоленская, О.С. Левин. — М.: МЕДпресс-информ, 2002. — 608 с.
.Шток, В.Н. Экстрапирамидные расстройства: рук-во для врачей / В.Н. Шток, О.С. Левин, Н.В. Федорова. — М.: Мед. информ. агентство, 2002. — 235 с.
.Шток, В.Н. Лечение паркинсонизма / В.Н. Шток, Н.В. Федорова. — М., 1997. — 196 с.
.Яхно, Н.Н. Современные принципы терапии болезни Паркинсона / Н.Н. Яхно, М.Р. Нодель // Рус. мед. журн. — 2000. — Т. 8, № 10. — С. 418-425.
.Antonini, A. Movement disorders: towards new therapies in Parkinsons disease / A. Antonini // Lancet Neurol. — 2012. — Vol. 11, N 1. — P. 7-8.
.Staging of brain pathology related to sporadic Parkinsons disease / H. Braak [et al.] // Neurobiol. Aging. — 2003. — Vol. 24. — P. 197-211.
Болезнь Паркинсона (БП) одно из наиболее распространённых нейродегенеративных заболеваний, конкурирующе за первое место с болезнью Альцгеймера. В большинстве случаев, первые симптомы — двигательные: тремор, замедленность движений и ходьбы, неустойчивость. На более поздних стадиях большинство пациентов страдает от нарушений работы других органов и систем: запоров, снижения артериального давления, развития апатии и депрессии, нарушений сна, в редких случаях — слабоумия.
В основе развития симптомов лежат два процесса:
- прогрессирующая утрата пигментированных дофаминергических нейронов компактной части черного вещества (Tretiakoff, 1919) со снижением уровня дофамина в головном мозге;
- образование в телах и отростках нейронов белковых скоплений, состоящих преимущественно из α — синуклеина — телец Леви (Lewi, 1912).
В начале заболевания патологический процесс ограничивается подкорковыми структурами мозга и их связями, а впоследствии — вовлекаются участки коры головного мозга и вегетативные ганглии полых внутренних органов (кишечника, мочевого пузыря).
Схема 1. Патологические изменения при развитии болезни Паркинсона
Распространённость
Данные о распространённости БП зависят от качества выявления пациентов. Средняя распространённость составляет 100 — 200 пациентов на 100 000 населения, это 60–80% от общего количества пациентов с паркинсонизмом. Численность больных в России оценивается в 210 000 человек.
Достоверных отечественных данных о частоте выявления новых случаев заболевания нет. По зарубежным данным 8 — 18,6 на 100 000 населения в год.
В большинстве исследований указывается на больший риск развития заболевания у мужчин. Частота заболевания увеличивается с возрастом.
Во всём Мире БП страдают около 7,5 миллионов человек.
Большинство случаев БП являются спорадическими, лишь в около 20% случаев удаётся отследить наследственную предрасположенность. С накоплением данных генетических исследований предполагается рост этой доли пациентов.
Таблица 1. Факторы риска болезни Паркинсона
| Немодифицируемые | Модифицируемые | |
|---|---|---|
|
Возраст (средний возраст развития 65 лет). Мужской пол (М: Ж 1,5:1). Генетическая предрасположенность:
|
Повышающие риск | Снижающие риск |
|
Проживание в промышленных районах. Контакт с тяжёлыми металлами (марганцем, свинцом, медью). Контакт с пестицидами (ротенон, паракват). Обструктивное апноэ сна (возможно, у женщин). |
Курение (может оказывать защитное действие). Кофеин (может снижать относительный риск; причинная связь не доказана). |
Генетическая предрасположенность к болезни Паркинсона
Учитывая что, около 20 — 25% пациентов, страдающих БП, имеют больных БП родственников первой степени родства, предполагается вклад генетических факторов в развитие заболевания. В крупном исследовании случай-контроль было установлено, что у лиц, имеющих родственников первой степени родства, больных БП, риск также заболеть в 2,3 раза выше, чем в контрольной группе. Близнецовые исследования указывают на значимость генетических факторов для развития заболевания с дебютом до 50 лет, но не позднее.
Наиболее убедительные данные в пользу генетической природы БП получены при оценке большой группы родственников больных БП с моногенным наследованием. Эти семейные формы паркинсонизма (обозначенные от PARK1 до PARK13) сочетались с мутациями в большом количестве ядерных генов, приводящими к развитию заболевания.
Были выделены аутосомные доминантные, аутосомные рецессивные и Х-сцепленные формы БП. Накапливаются данные о роли отдельных генов и групп генов в развитии БП. В мета-анализе результатов геномных исследований, выполненном в 2014 году, по данным оценки 13 700 больных БП и 95 000 лиц контрольной группы было выделено 28 отдельных вариантов генов, сочетающихся с развитием БП, которые располагались в 24 локусах. Однако, указывается на то, что генетические исследования могут переоценивать риск изменения отдельных локусов ввиду системных ошибок исследований «случай-контроль». Кроме того, результаты исследования не обладают достаточной точностью для того, чтобы служить основой для оценки риска БП в клинических условиях.
В приложении 1 приводится набор генетических факторов риска и моногенных форм БП, о которых известно к настоящему времени.